逆転の化学『有機化合物』の学習です。大学入試まであとわずか、化学の知識を一緒に整理していきましょう。文系の筆者が理系科目を説明するので、初心者にもわかりやすく説明することができると思います。是非活用してください。中でも暗記が大変な有機化合物についてのざっくりとした内容を抑えていきましょう。
『アルカン』とは
官能基、異性体、構造式決定手順と勉強してきましたが、ここから具体的な有機化合物について勉強していきましょう。化合物の中でも炭素Cと水素Hだけでできている有機化合物を炭化水素といいます。メタンCH4などは今までよく出てきたと思いますが、メタンも炭化水素です。炭化水素の分子式はC○H○と表すことができます。
『アルカン』の構造式
炭化水素の中でも単結合(C‐CやC‐H)だけでできていて、環構造をもたない鎖状の構造をしたものを『アルカン』といいます。以下のようなものが考えられます。途中で枝があっても、環構造がなければアルカンになります。
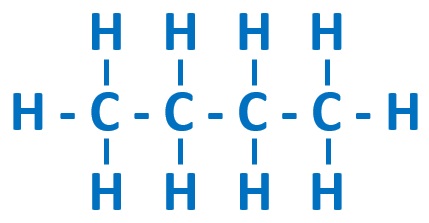
アルカンの分子式を表す一般式は、
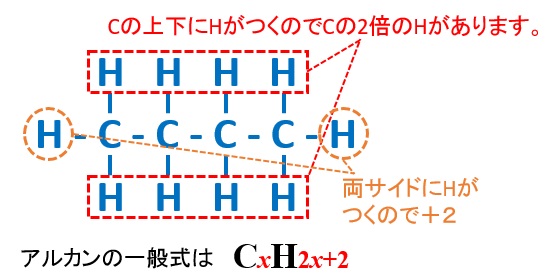
となります。このように共通の一般式で表される化合物のことを同族体といいます。
『アルカン』の同族体
途中に枝わかれがない直鎖の場合は次の通り。
| 炭素の数 | 分子式 | 名称 | 構造式 |
| 1 | CH4 | メタン | CH4 |
| 2 | C2H6 | エタン | CH3-CH3 |
| 3 | C3H8 | プロパン | CH3-CH2-CH3 |
| 4 | C4H10 | ブタン | CH3-CH2-CH2-CH3 |
| 5 | C5H12 | ペンタン | CH3-CH2-CH2-CH2-CH3 |
| 6 | C6H14 | ヘキサン | CH3-CH2-CH2-CH2-CH2-CH3 |
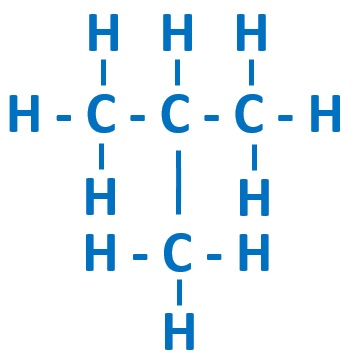
異性体が存在するのは、ブタンC4H10からです。途中で枝がある構造が考えられます。
ブタンC4H10
■2-メチルプロパン
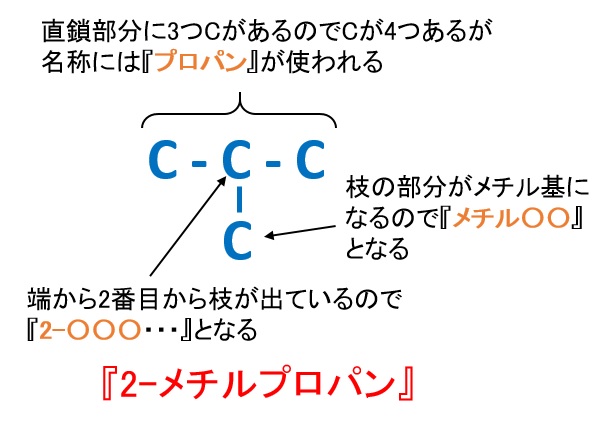
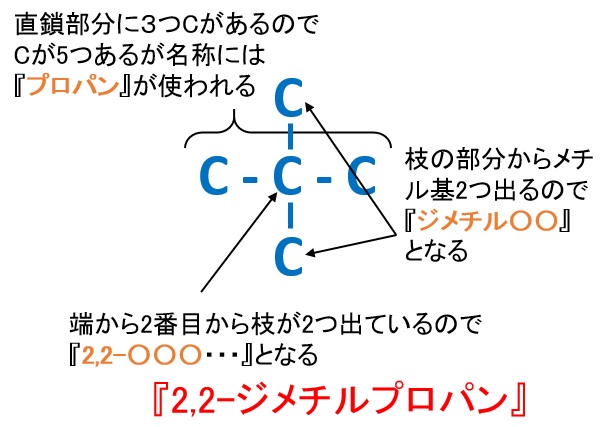
ペンタンC5H12
■2-メチルブタン
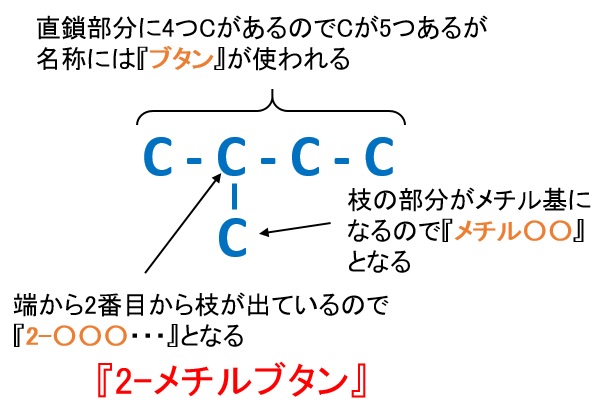
■2,2-ジメチルプロパン
ヘキサンC6H14
ヘキサンにも以下のような鎖型の枝わかれパターンの構造異性体があります。自分で構造式が書けるか確認してみてください。
■2-メチルペンタン
■3-メチルペンタン
■2,3-ジメチルブタン
■2,2-ジメチルブタン
『シクロアルカン』とは
環構造をもつアルカン(飽和炭化水素)をシクロアルカンといいます。一般式はCxH2xで表されます。ここは後日詳述します。
以上がアルカンについての基礎知識です。しっかりとマスターしてください。
アルカンの物理的性質
アルカンは、分子量が大きくなるほどファンデルワールス力が大きくなりますので、分子間の結合力が強くなり沸点や融点が高くなります。つまり、炭素Cの数が多ければ多いほど、沸点・融点は高くなるのです。
また枝わかれしているよりも直鎖の方が、分子間の接触面積が大きくなり分子間力は強くなります。
水への溶け方(溶解性)は、CとHは電気陰性度に若干の違いがありますが(Cの方が大きい)、分子全体でみると電気の偏りを打ち消し合い無極性分子になっています。したがって、極性の大きな水には溶けにくいです。しかし、極性の小さなエーテルやベンゼンなどの有機溶媒には良く溶けます。
アルカンの化学的性質
アルカンは無極性分子で、しかも全て単結合の飽和した状態です。なので極めて不活性でなかなか反応しません。アルカンの反応は次の反応を覚えれば十分です。
塩素Cl2 + 光 による置換反応 (ハロゲン化)
次のように、次々とHがClに置き換わっていきます。
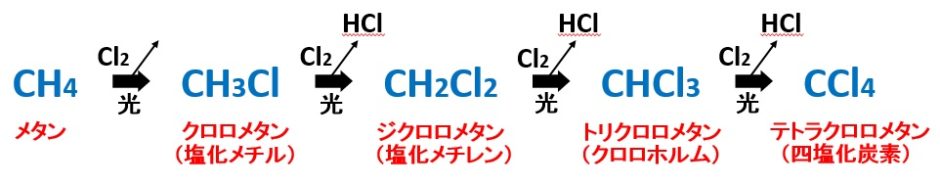
化合物の名前をしっかり覚えてください。
アルカンの製法
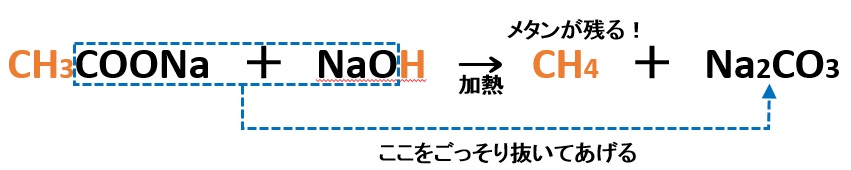
アルカンの中でもメタンCH4は、実験室的に発生させる場合、酢酸ナトリウムCH3COONaと水酸化ナトリウムNaOHを加熱して発生させます。
LNGとLPG
アルカンの中でもメタンCH4は天然ガスの主成分で、この天然ガスを-160℃の極低温で加圧し、液化したものをLiquefied Natural Gas略してLNG(液化天然ガス)といいます。用途は、都市ガスや発電用燃料になります。
プロパンC3H8やブタンC4H10は石油から副次的に出てくる石油ガスで、これを室温で加圧し、液化したものをLiquefied Petroleum Gas略してLPG(液化石油ガス)といいます。用途は、家庭用プロパンガスやタクシーの燃料として使われたりしています。


コメント