大学入試まであとわずか、化学の知識を一緒に整理していきましょう。文系の筆者が理系科目を説明するので、初心者にもわかりやすく説明することができると思います。是非活用してください。中でも暗記が大変な有機化合物についてのざっくりとした内容を抑えていきましょう。
異性体とは
有機化合物の中には、分子式が同じでも結合の種類によって性質が変わったり、結合の種類が同じでも異なる性質を示すものもあります。分子式が同じでも性質が異なる化合物を総称して異性体といいます。
まずは、次の2つの有機化合物C2H6Oを見てください。
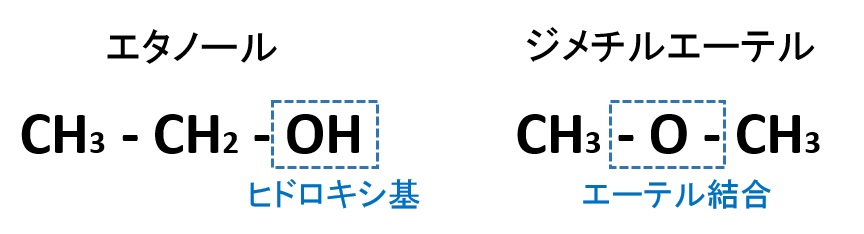
どちらも分子式はC2H6Oですが、官能基の違いがります。エタノールにはヒドロキシ基-OH、ジメチルエーテルにはエーテル結合-O-の違いがあります。そのため、エタノールは分子間で水素結合をつくり高い沸点(78℃)をもちますが、ジメチルエーテルは無極性分子で、分子間力が弱く、エタノールに比べて沸点(-25℃)が低くなります。
このように、分子式が同じでも、官能基などの違いにより、性質が大きく異なってきます。異性体は、分子式が同じで、構造が異なるものどうしで、次のように分類できます。
異性体の分類
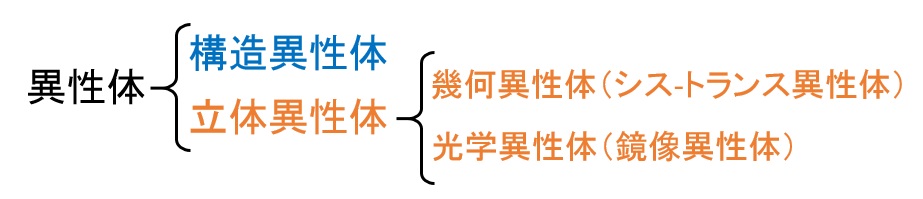
異性体の中でも構造式が異なるものを「構造異性体」と呼び、立体的な形が異なるものを「立体異性体」と呼びます。
構造異性体
構造異性体には次の3つのタイプがあります。
構造異性体①(炭素Cの骨格が異なるパターン)
炭素Cの骨格の違いによる異性体で、主鎖(最も長い炭素鎖)と側鎖(枝分かれした炭素鎖)の違いや、不飽和結合の種類や位置によってできる構造異性体です。
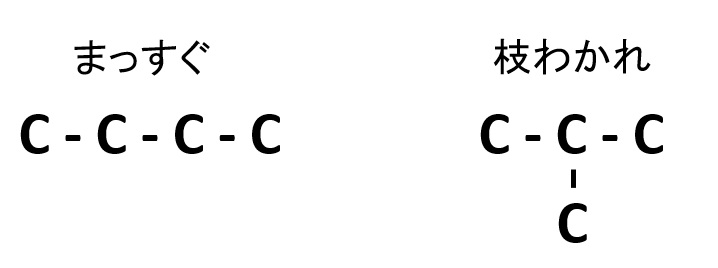
構造異性体②(官能基の種類が異なるパターン)
同じ分子式でも異なる官能基を持つことがあります。ヒドロキシ基-OHやエーテル結合-O-のように官能基が異なるパターンです。

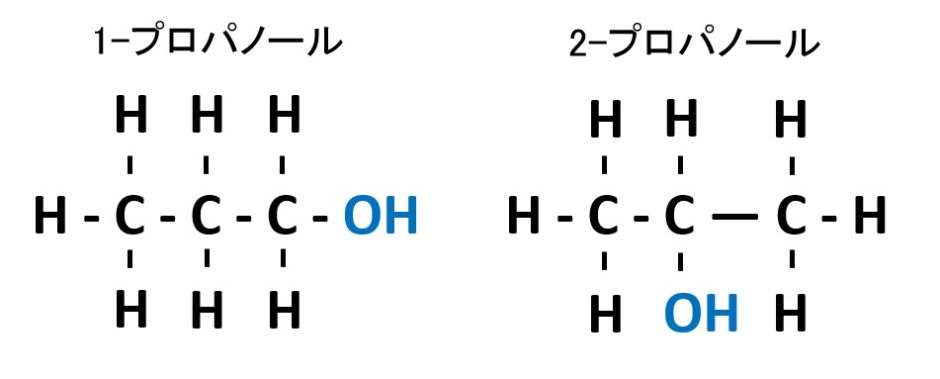
構造異性体③(官能基の位置が異なるパターン)
炭素C骨格についている官能基の位置が異なるパターンです。例えば、プロパノールには次の構造異性体があります。どちらも分子式はC3H8O
立体異性体
立体異性体は、大きく分けて2つに分類することができます。1つは「幾何異性体(シス‐トランス異性体)」、もう一つは「光学異性体(鏡像異性体)」です。
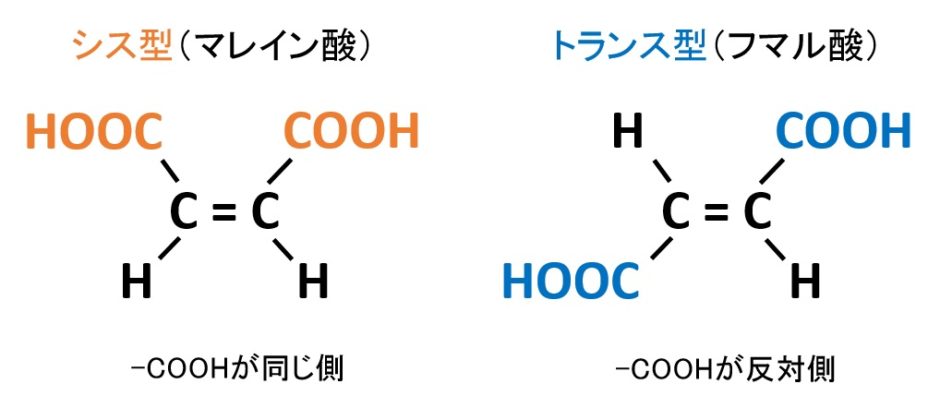
幾何異性体(シス‐トランス異性体)
幾何異性体とは、二重結合で結合するC原子への置換基の配置が異なる異性体です。C=CはC-Cと違い左右の炭素原子が自由に回転できないため、幾何異性体が生じます。置換基同士が隣接しているものものを「シス型」、隣接していないものを「トランス型」といいます。
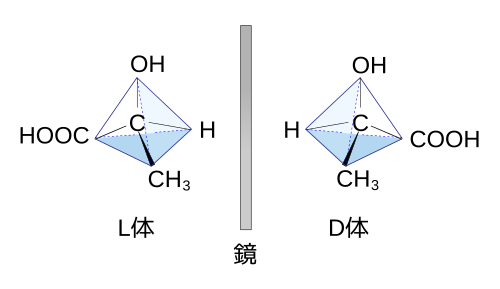
光学異性体(鏡像異性体)
X、Y、Z、W(4つとも異なる原子や原子団)が結合している炭素原子を「不斉炭素原子」といいます。不斉炭素原子をもつ分子には、鏡に映すものと鏡に映ったものの関係にある1組に立体異性体が存在します。この立体異性体は鏡像の関係にあるので、「鏡像異性体」と呼んだり、光に対する性質が異なるので「光学異性体」と呼んだりします。光に対する性質が異なったり、味やにおいが異なることもあります。
異性体の見つけ方
前回の内容で、どのような異性体があるか分かったと思います。念のためにもう一度示しておきますね。

今日は、分子式からどのような異性体が存在するのか、探し方を伝授します。その前に覚えてほしいことがありますので、まずここを覚えてしましましょう。それは、炭素Cの骨格のパターンです。
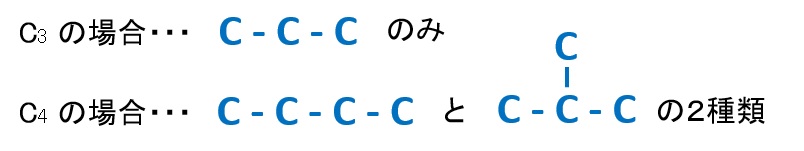
炭素Cの骨格のパターン(C3とC4の場合)
○鎖状構造(環をもたない場合)
○環構造(輪っかになっている場合)
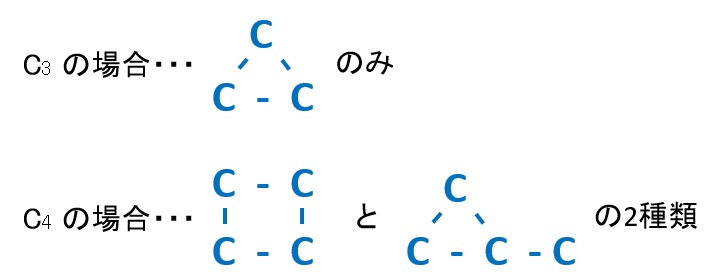
以上の炭素Cの骨格があることを覚えておいてください。では、異性体の見つけ方を手順を追って説明します!
1.分子式から不飽和度を求める
不飽和度とは、簡単に言うと分子の中の環の数と二重結合の数のことです。不飽和度を調べることによって、その分子中に環が何個あるのか、また炭素C骨格の二重結合が何個あるのかが分かります。なので、まず不飽和度を求めることから始めてください。
分子式がCxHyOzやCxHyのとき、

不飽和度が0の場合は、
炭素C骨格は全て単結合からなります。
不飽和度が1の場合は、
①二重結合(C=CやC=O)が1つ
②環構造が1つ
のどちらかの構造が入っています。
不飽和度が2の場合は、
①三重結合(C≡C)が1つ
②二重結合(C=CやC=O)が2つ
③環構造が2つ
④二重結合が1つと環構造が1つ
のどれかの構造が入っています。
不飽和度が4の場合は、
①ベンゼン環が1つ ※後で紹介します。
②不飽和度が4になるように、三重結合、二重結合、環構造が含まれる
のどれかになりますが、ほとんどベンゼン環になります。
不飽和度を計算して、不飽和度が0になった場合には二重結合も環構造も考えられませんので、手順2の後は4に進むことになります。不飽和度が0にならなかった場合や、酸素原子Oが含まれる場合には、手順2の後3に進んでください。
例えば、C4H8の分子式の場合、不飽和度を求めると不飽和度は1になります。不飽和度が0にならなかったので、手順2の後、手順3を考えることになります。
2.鎖状構造の炭素C骨格パターンを全て書く
例えば、C4H8の分子式の場合、炭素C骨格が4つからできているので、考えられる鎖状構造は、
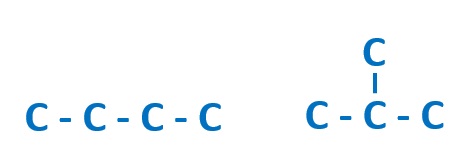
の2通りが考えられます。これを全て書き出しておきます。
3.二重結合や官能基、環構造を炭素C骨格に当てはめてみる
例えば、C4H8の分子式の場合、不飽和度が1でしたので、二重結合が1カ所か、環構造が1つ入ることになります。
C4H8の場合、鎖状構造だったら、
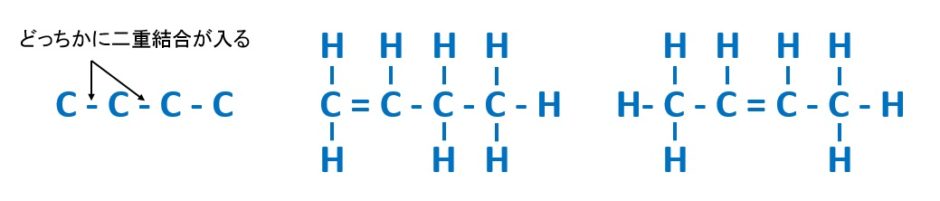
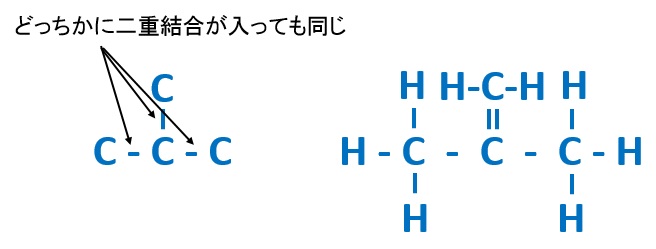
の3パターンが考えられます。
環構造が1つ入ることも考えられるます。考えられる環構造は、炭素Cが4つなので、
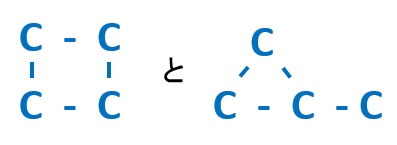
の2パターン考えられます。ここまで合計5パターン考えられます。
4.幾何異性体や光学異性体がないか検討する。
最後に幾何異性体(シス‐トランス異性体)や光学異性体(鏡像異性体)がないか、ここまで考えた異性体すべてを見ていきます。
ここまでの4段階の手順で、異性体を探し出して行くことになります。面倒ですが、数をこなして慣れていくしかありませんね。頑張ってください。

コメント